Актуальность данной проблемы бесспорна. Прежде всего, она обусловлена частотой рецидивов рака мочевого пузыря после трансуретральной электрорезекции. По данным литературы частота ранних рецидивов, в первые три месяца после трансуретральной резекции, достигает 60%, а частота рецидивов в первые пять лет достигает 90% [6]. При возникновении рецидива может снижаться степень дифференцировки опухоли и возрастать глубина инвазии, что значительно ухудшает прогноз. Одной из основных причин рецидивов РМП является наличие мелких папиллярных, а также плоских эндоэпителиальных опухолей (рак in situ), не выявленных, а потому и не удаленных, во время ТУР.
Данные исследований различных авторов, в которых проводились повторные контрольные ТУР мочевого пузыря через 2-8 недели после первой резекции, показали, что короткий срок между двумя операциями исключает образование истинных рецидивов. Как мы видим, у 31-75% пациентов выявлены не удаленные при первой резекции опухоли.
Эти данные показывают, что по причине синхронного и метасинхронного мультифокального роста карциномы уротелия обязательно существует необходимость удалять не только видимые опухоли, но и анализировать области, кажущиеся нормальными. В практической диагностике для этого существуют рандомная биопсия и цитология мочи или промывных вод.
Но удастся ли это с помощью используемой для гистологической оценки мочевого пузыря рандомной биопсии, сомнительно. Попытки с помощью нецеленаправленной биопсии слизистой, имеющей нормальный вид, найти carcinom in situ или дисплазию - дело случая. Кименей и сотрудники установили, что несмотря на дополнительную отрицательную рандомную биопсию в почти 40% случаев после резекции солитарной опухоли надо расчитывать на рецидив в течение 3 лет [21]. Обширное мультицентрическое сравнительное исследование BCG и митомицина С в отношении профилактики рецидива показало, что факультативная рандомная биопсия не обнаружила влияния на появление рецидива и его прогрессирование. Если же все-таки были выявлены дисплазии или carcinoma in situ, то эти больные имели значительно более высокую степень прогрессирования [ 21].
Таким образом, по причине своей малой чувствительности рандомная биопсия как практический метод гистологического выявления плоских образований сомнительна.
Преимущество цитологического исследования заключается в полной оценке спущенных клеток из всех областей мочевого пузыря. Его клиническая важность обусловлена высокой чувствительностью при обнаружении низкодифференцированных новообразовательных изменений. Чувствительность при выявлении дисплазий или опухолей более низкой степени злокачественности однако, неудовлетворительна [15]. Кроме того, цитология охватывает только клетки на поверхности. Клетки, расположенные вблизи базальной мембраны, не поддаются диагностике. Ровно также ничего нельзя сказать по поводу важной для прогнозирования глубины инфильтрации или о инвазии в лимфу или кровеносные сосуды. Во многих мультицентрических первоиспытаниях, в которых цитология мочи или промывных вод сравнивалась с Bladder Tumor Antigen Test (тест ВТА), обнаружилась разочаровывающе низкая чувствительность, составляющая соответственно 16, 28 и 32% в области цитологии в учете опухолей уротелия. Даже при carcinoma in situ чувствительность составила лишь не более 56% [14]. Эти данные исключают последующее наблюдение исключительно путем цитологии и подтверждают значимость эндоскопической оценки слизистой для диагностики опухолей мочевого пузыря.
Подводя итоги, эти познания подтверждают, что ни эндоскопия в белом свете, ни рандомная биопсия или цитология не способны точно определить опухолевые процессы при поверхностном раке мочевого пузыря. Они не позволяют распознать в полном объеме все опухолевые образования или же предоставить информацию о таких важных прогностических параметрах как поражение стенки мочевого пузыря, лимфатическая или сосудистая инфильтрация.
Классические эндоскопические меры не в состоянии точно определить процессы в опухоли при поверхностном раке мочевого пузыря.
Все вышеизложенное дало основание для поиска новых методов диагностики для улучшения визуализации опухолей.
На этом фоне уже давно существовали попытки разработать методы маркировки ин виво неоплазий уротелия. Первые опыты по флуоресцентной маркировке были проведены в начале 60-х годов Витмором и сотрудниками с тетрациклинами [32]. Но так как взятие проб под флуоресцентным свечением не было возможно, то, несмотря на многообещающее начало, ни к какому дальнейшему развитию данного способа это не привело. В 1983 году японская рабочая группа сообщала о внутрипузырном применении метиленового синего для маркировки низкодифференцированных неоплазий и микроинвазивных ранних стадий рака [15]. Клиническая проверка показала, однако, недостаточную чувствительность этого метода [15]. В 80-х годах были разработаны методы распознавания с применением системно апплицируемых синтетических порфиринов [15]. Этот метод сделал в принципе возможным отображение флуоресценции неоплазий уротелия в ткани. Однако дорогостоящая техника активации флуоресценции и обработки изображения, а также фототоксические реакции кожи препятствовали завоеванию своего места в клинической практике.
В Мюнхене в госпитале Гроссхадерн Университета Людвига Максимилиана был разработан новый метод флуоресцентного обнаружения опухолей мочевого пузыря [23]. Он основан на избирательном накоплении протопорфирина IX в опухолевых тканях при внутрипузырном введении 5-аминолевулиновой кислоты (5-АLA), флюоресценция возникает при освещении мочевого пузыря сине-фиолетовым светом (рис.1, 2).
Рис.1 Цистоскопия в белом свете |
Флюоресцентная цистоскопия |
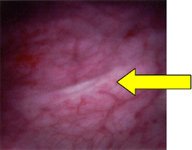 |
Нормальная слизистая мочевого пузыря |  |
Рис.2 Цистоскопия в белом свете |
Флюоресцентная цистоскопия |
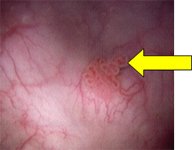 |
Мелкие папиллярные опухоли без перитуморальной флюоресценции (pTaG1) | 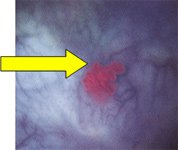 |
Было установлено, что чувствительность флуоресцентной цистоскопии составляет более 96,9% и превосходит более чем на 20% чувствительность цистоскопии в белом свете (72,7%) [27]. Различий в специфичности методов исследования не отмечено. Полученные результаты затем были подтверждены другими авторами [17, 21, 24]. Благодаря высокой чувствительности этого метода, стало возможным воздержаться от взятия биопсий у пациентов с нефлюоресцирующими участками стенки мочевого пузыря. Казалось также разумным выполнить ТУР мочевого пузыря в флуоресцентном освещении. Многоцентровое рандомизированное исследование показало значительную разницу в радикальности трансуретральной резекции с флуоресцентной эндоскопией по сравнению с обычной эндоскопией в белом свете. Благодаря флуоресцентному осмотру мочевого пузыря во время ТУР число пациентов с оставленными после резекции опухолями удалось снизить на 40% [55].
В РОНЦ РАМН было проведено исследование по изучению диагностических возможностей флуоресцентной цистоскопии в поиске начальных стадий рецидивов рака мочевого пузыря, когда его невозможно визуализировать обычно применяемыми средствами. Применяли флуоресцентную цистоскопию сразу после окончания стандартной ТУР мочевого пузыря в белом свете для поиска остаточной опухоли, которая не определяется при обычном осмотре, что явилось дополнительным контролем за радикальностью операции. При исследовании использовался 3% раствором 5-АLА. Для возбуждения флюоресценции применялся источник света D-Light, Karl Storz.
В качестве источника света использовалась 300-ваттная ксеноновая лампа с фильтрами, которая дает мощный световой поток, особенно в сине-фиолетовой области спектра 385-440 нм, поскольку именно в этом свете протопорфирин IX, селективно накапливающийся в опухоли при местном введении 5-аминолевулиновой кислоты, особенно эффективно превращает свет возбуждения в красный цвет флюоресценции.
Использовалась специальная оптика резектоскопа Karl Storz с длинноволновым фильтром (более 490 нм), для того чтобы передавать красный свет флюоресценции и задерживать большую часть фиолетового света, используемого для возбуждения. Таким образом, флюоресцирующие участки слизистой проявлялись как красные, тогда как нефлюоресцирующая слизистая оставалась синей.
За 1- 4 ч. до операции в мочевой пузырь вводится 3% раствор 5-А1-А. Пациенты удерживают раствор в течение 1-2 часов. Операция начинается в белом свете, так как, хорошо видимые опухоли следует удалять посредством стандартной ТУР. Затем мочевой пузырь освещается сине-фиолетовым светом (длина волны 380-440 нм). Такая последовательность в проведении исследования позволила получить несколько важных преимуществ по сравнению ТУР, проводимой в сине-фиолетовом свете:
1. Время флуоресцентной цистоскопии уменьшается и, следовательно, меньше условий для фотообесцвечивания протопорфирина IХ в мелких опухолях, расположенных рядом с местами резекции.
2. Появляется возможность определить количество неудаленных опухолей после стандартной ТУР.
3. Такое применение флуоресцентного контроля позволяет сравнить эффективность выявления опухолей при стандартной ТУР и операциях с 5-АLA индуцированной флюоресценцией в одной группе больных.
При обнаружении флюоресцирующих областей слизистой мочевого пузыря выполняется "холодная биопсия" во избежание термических повреждений взятых тканей. После биопсии проводится ТУР всех флюоресцирующих областей, флуоресцентный контроль заканчивается взятием биопсии из неизмененных, нефлюоресцирующих участков мочевого пузыря для определения ложноотрицательных результатов.
В РОНЦ РАМН был проведен ТУР с флуоресцентным контролем 85 больным (14 женщин и 71 мужчина)[8,9]. Средний возраст больных составил 59,7 года (от 25 до 87 лет). Из 85 больных у 57 были удалены множественные опухоли, у 28 - единичные. 43 пациентам ТУР была проведена впервые, у 42 операции выполнены по поводу рецидивных опухолей. Ни в одном случае не было отмечено системных или местных побочных эффектов после внутрипузырного введения 5-аминолевулиновой кислоты. При флуоресцентном контроле после ТУР у 60 (70,6%) пациентов отмечались участки флюоресценции слизистой[8].
Рис.3 Цистоскопия в белом свете |
Флюоресцентная цистоскопия |
 |
Carcinoma in situ (Cis) рядом со старым резекционным швом |  |
Какие же ткани флюоресцировали? Ответ на этот вопрос дают результаты гистологических исследований флюоресцирующих участков уротелия.
Из 60 пациентов у 46 (74,5 %) были выявлены раковые опухоли, из них у 14 (30,4 %) - рак in situ (рис.4).
Лишь у 14 (24,5%) больных флюоресценция была обусловлена воспалением или дисплазией тканей. При гистологическом исследовании флюоресцирующих участков ни в одном случае не выявлено нормальных, неизмененных участков слизистой (рис.5).
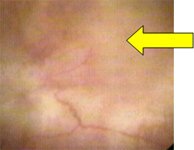
Рис.4 Цистоскопия в белом свете |
Флюоресцентная цистоскопия |
Флюоресцентная микроскопия.
В результате флуоресцентного контроля после ТУР в белом свете у 46 (54,1%) пациентов из 85 были дополнительно выявлены и удалены раковые опухоли. На частоте дополнительно выявляемых новообразований сказывалось их количество перед ТУР. Из 57 пациентов с множественными опухолями у 40 (70,2%) после ТУР были обнаружены неудаленные опухоли. В то время как в группе больных с единичными образованиями они обнаружены лишь у 6 (21,4%) из 28[4,8]. В 10 случаях при гистологическом исследовании экзофитных образований, удаленных во время ТУР в белом свете, раковых клеток выявлено не было. Все эти больные были оперированы в связи с подозрением на рецидив, после проведения иммунотерапии или химиотерапии. Следует отметить, что только благодаря флуоресцентной цистоскопии после ТУР у 4 из этих пациентов были выявлены, а затем удалены раковые опухоли.
Всего была произведена 301 биопсия - 129 биопсий из флюоресцирующих тканей, выявленных после ТУР, и 172 из нефлюоресцирующих областей. В 76 биоптатах из флюоресцирующих участков были выявлены раковые опухоли. Лишь в одном случае при биопсии из нефлюоресцирующей слизистой были обнаружены раковые клетки. В результате анализа результатов биопсий была вычислена чувствительность флуоресцентного контроля - 98,7%, специфичность - 76,3%[8]. По данным других авторов чувствительность и специфичность метода также высока – 97,0% и 75,6% соответственно [1,3]. При наблюдении за 30 больными со стадией заболевания Та-1 в течение 1 года после ТУР с флуоресцентным контролем выявлен рецидив рака мочевого пузыря у 5 (16,6%) пациентов.
Тогда как в контрольной группе, аналогичной по степени анаплазии, кратности опухолей, а также по дальнейшей профилактической терапии, у 9 (30%) пациентов выявлен рецидив в первый год после стандартной ТУР. Как видно из представленных данных, применение флуоресцентной цистоскопии показало, что обычные методы диагностики не в состоянии выявлять большое количество новообразований в начальных стадиях своего развития. Более чем у половины больных (в 54,1% случаев) после ТУР были оставлены раковые опухоли, из них в 30,4% - рак 1п 511и. Эти опухоли при повторном обследовании могли быть расценены как рецидивные, хотя, по сути, являлись продолженным ростом незамеченных при осмотре в белом свете опухолей.
Флуоресцентная цистоскопия обладает высокой чувствительностью и специфичностью. Этот метод облегчает визуализацию мелких папиллярных опухолей и рака in situ, что обеспечивает больший радикализм оперативного лечения, особенно у больных с множественными опухолями. Применение 5-АLА-индуцированной флюоресценции с целью контроля после ТУР позволило повысить радикализм резекции и уменьшить количество рецидивов в первый год в два раза.
Флюоресцентная диагностика с применением 5-АЛК показала, что имеется большой потенциал в выявлении злокачественных опухолей уротелия, включая ранее не выявленный рак, а также предраковое состояние. Все это позволяет значительно увеличить точность эндоскопической диагностики, повысить радикальность трансуретральной резекции мочевого пузыря. Несмотря на увеличение затрат при проведение данного исследования, представляется возможным избежать повторных трансуретральных резекций в ранние сроки (second-TUR). Ожидается, что флюоресцентная диагностика станет золотым стандартом в программе обнаружения рака мочевого пузыря.
СПИСОК ЛИТЕРАТУРЫ.
1. Аль – Шукри С.Х, Данильченко Д.И., Кениг Ф., Шпор Д.// Урология. – 2000г. - №5. – с. 49 – 51.
2. Использование Метронидозола в качестве радиосенсибилизатора при лучевом лечении больных со злокачественными новообразованиями и определение его концентрации в сыворотке крови.// Методические рекомендации. - М. - 1989г.
3. Клименко И.А., Романенко А.М.// Вопросы онкологии. – 1986. - №6. – с. 76-81.
4. Клименко И.А.// Урология и нефрология. – 1998. - №2. – с. 33-37.
5. Лопаткин Н.А., Камалов А.А., Токарев Ф.В., Ефремов Е.А.// Материалы 4-й Всероссийской научной конференции с участием стран СНГ по раку мочевого пузыря. – М. – 2001г. – с.17-18.
6. Лопаткин Н.А., Мартов А.Г., Гущин Б.Л., Кудрявцев Ю.В., Сысоев. // Урология и нефрология. – 1998. - №5. – с. 9-12.
7. Матвеев Б.П., Курашев Б.В., Бухаркин Б.В., Романов В.А., Рубанов Ю.В.// Урология. – 2000г. - №3. – с. 22-24.
8. Матвеев Б.П., Фигурин К.М., Карякин К.М.// Рак мочевого пузыря. – М. – 2001г. – с.43-48.
9. Матвеев Б.П., Шипилов В.И., Гоцадзе Д.Т.// Урология и нефрология. – 1990. - №3. – с.53-56.
10. Пряничникова М.Б.// Доклиническая диагностика и профилактика рака мочевого пузыря на основе эпидемиологических исследований. - дис. доктор. – М. – 1990.
11. Трапезников Н.Н., Аксель Е.М.// Заболеваемость злокачественными новообразованиями и смертность от них населения стран СНГ в 1996.- М., - 1997г. – с. 5-9.
12. Althausen AF, Prout GR, Daly JJ// J Urol. – 1976. – Vol. 116. – P.575-580.
13. Cummings KB, Mason JT, Correa RJ, Gibbons RP // J Urol. – 1978. – Vol.119. – P.56-58.
14. D’hallewin MA, Baert L// Jurol. – 1996. – Vol.155. – P. 475.
15. Fukui I, Yokokawa M., Mitani G. // J Urol. – 1983. – Vol. 130. – P. 252-255.
16. Goffinet DR, Schneider MJ, Glatstein EJ, et al.// Radiology. – 1975. – Vol.17. – P.149.
17. Huncharek M, Muscat J, Geschwind JF.// Anticancer Res. – 1998. – Vol.18(3B). – P.1931-1934. – Vol.50. - P.903-908.
18. International Union Against Cancer. TNM classification of malignant tumors. 4th ed, 2nd // Germany: Springer-Verland. - 1992.
19. Jichlinski P, ForrerM, MizeretJ, etal.// Lasers-Surg-Med. - 1997. - Vol.20. - P402-408.
20. Jocham D, Baumgartner R, Fuchs N, Lenz H, Stepp H, Unsold E. // Urologe. – 1989. – Vol. 28. – P.59.
21. Johnson HA, Pavelec M.// J NatI Cancer Inst. – 1973. – Vol.50. – P. 903-908.
22. Kiemeney Lalm, Witjes JA, Heijbroek RP, Verbreek Alm, Debruyne FMJ.// J Urol. – 1993. – Vol.150. – P.60-64.
23. KlanR., LoyV., HulandH.// Urology. – 1991. – Vol.146. – P. 316-318.
24. Kohrmann KU, Woeste M, Kappes J, Rass-Weiler J, Alken P. // Akt Urol. – 1994. – Vol. 25. – P. 208-213.
25. KriegmairM, BaumgartnerR., KnuchelR., etal.// Urology. – 1996. – Vol.155. – P.105-110.
26. Mersdorf A, Brauers A,Johannes M et al. //TUR for superficial bladder cancer: a must? – 1998. - AUA Meeting CD-ROM.
27. Results of a multicenter trial using the BTA test to monitor for and diagnose recurrent bladder cancer. // J Urol. – 1995. – Vol. 154. – P. 379.
28. Sell A, Jakobson A, Norstrom B. // Scand J I Nephrol. SuppI 1991; 138:193.
29. Step h., Wagner S., Zaak D., Knuchel R.// 1998,Germany P 39-41.
30. Vicente J, Chechile G, Algba F. // EurUrol. – 1987. – Vol.13. – P. 15.
31. Wallace DMA, Raghavan D, Kelly K, et al.// BrJ Urol. – 1991. – Vol.67. – P.608.
32. Whitmore W.F., Bush I.M.// J. Urol. – 1996. – Vol. 95. – P.
33. Zietman AL, Shipley WU, Heney NM, Althausen AF. //Semin Urol Oncol. – 1997. – Vol.15(3). – P.161-168.
Как приложить файлы для обращения к доктору.
1) Скопировать адрес 89036832277@yandex.ru.
2) Отправить со своего почтового ящика письмо с прикрепленными файлами.
Результаты МСКТ или МРТ (содержимое диска) предварительно нужно заархивировать (формат ZIP или RAR).
По предварительной договорённости консультация возможна в вечернее время или в выходные дни.